Zanieczyszczenia powietrza
Zanieczyszczenia powietrza wpływają negatywnie nie tylko na zdrowie ludzi, zwierząt roślin, lecz
także na stan wody i gleby.
Źródła zanieczyszczeń powietrza można
podzielić na naturalne i antropogeniczne, czyli wytworzone przez człowieka lub
będące wynikiem jego działalności.
Do skutków zanieczyszczeń powietrza zalicza się: smog, kwaśne opady, dziurę ozonową,
zwiększenie efektu cieplarnianego.
Żródła zanieczyszczeń powietrza
źródła naturalne
- pożar lasów
- wybuchy wulkanów
- wyładowania atmosferyczne
źródła antropogeniczne
- transport m.in. samochodowy
- produkcja przemysłowa, m.in. rolnictwo
- elektrownie węglowe
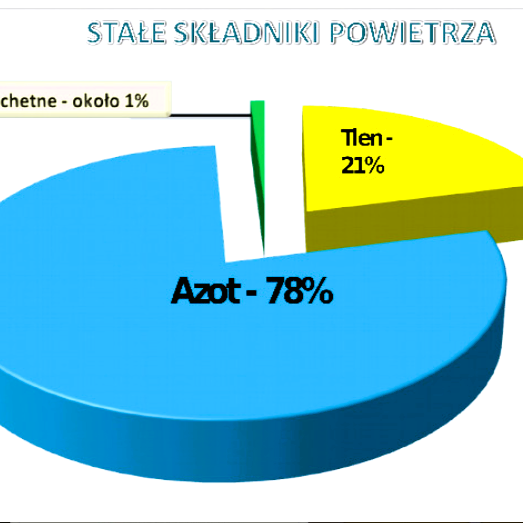
| Stan skupienia |
Przykłady zanieczyszczeń powietrza |
| gazowy |
tlenek siarki(IV), tlenek węgla(IV), tlenek węgla(II) |
| ciekły |
freony pochodzące z aerozoli |
| stały |
pyły, tlenki metali, metale ciężkie, dym (sadza) |
Smog czyli mgła przemysłowa, tworzy się w wyniku wymieszania
mgły (pary wodnej) z pyłami, dymem, tlenkami azotu, tlenkami węgla(IV) i tlenkiem
siarki(IV).
Kwaśne opady powstają, gdy tlenki siarki i
azotu łączą się z wodą (parą wodną) znajdującą się w powietrzu i spadają z
deszczem lub śniegiem na ziemię.
Dziura ozonowa powstaje w wyniku zmniejszania się ilości
ozonu w stratosferze. Największy udział w powstawaniu dziury ozonowej mają freony, czyli
związki chemiczne stosowane dawniej w lodówkach i aerozolach. Dziura ozonowa jest przyczyną
zwiększania ilości docierającego na Ziemię promieniowania ultrafioletowego (UV).
Efekt cieplarniany powstaje w wyniku zatrzymania ciepła
emitowanego przez Ziemię przez gazy obecne w atmosferze. Są one nazywane gazami
cieplarnianymi. Należą do nich m.in. tlenek węgla(IV), tlenek węgla(II), ozon, para
wodna i metan. Skutkiem efektu cieplarnianego są zmiany klimatyczne.