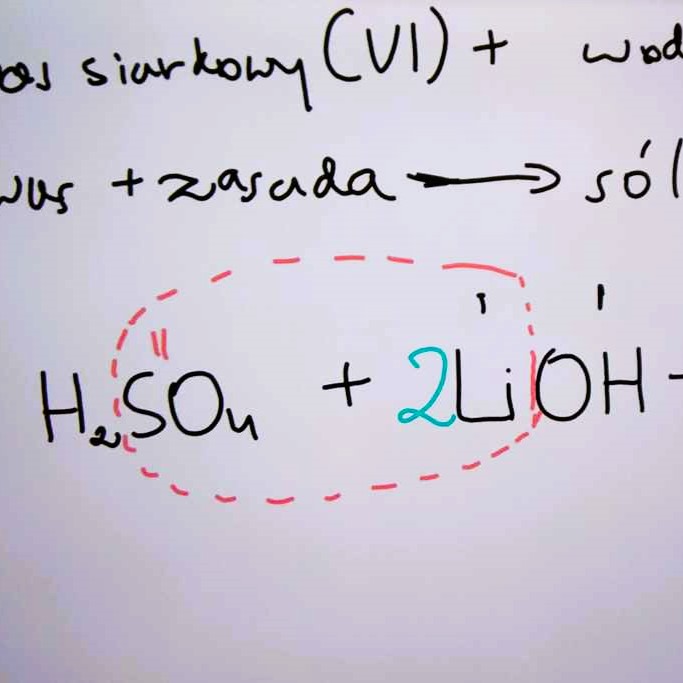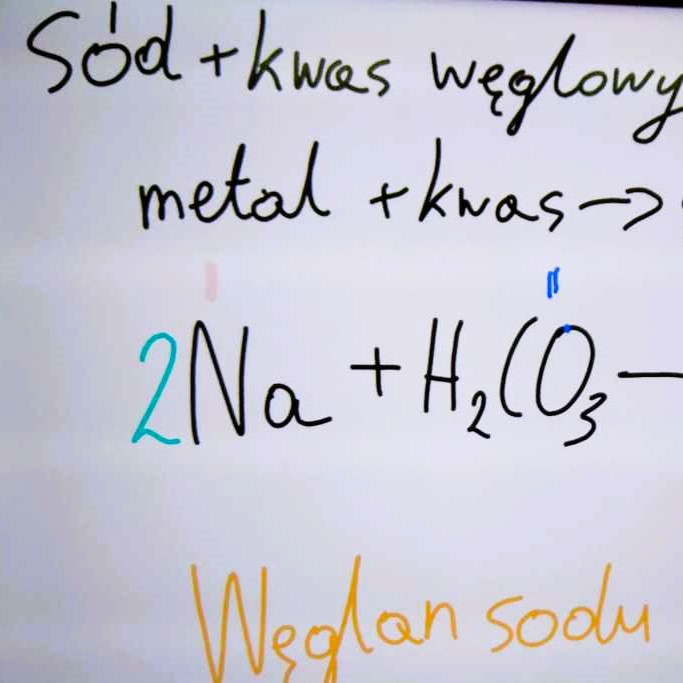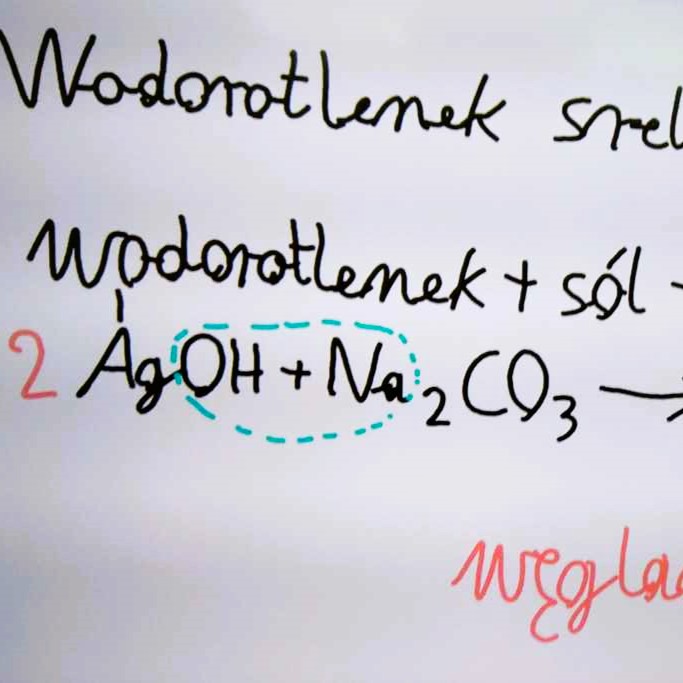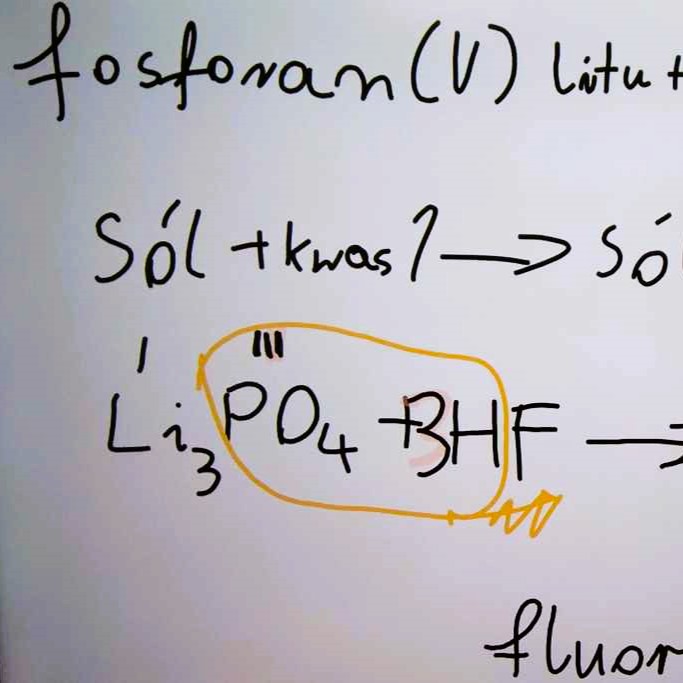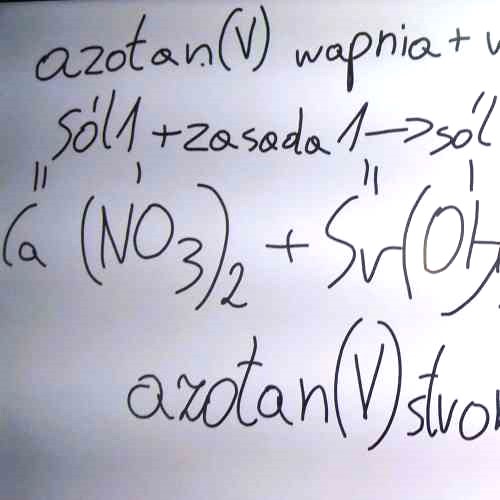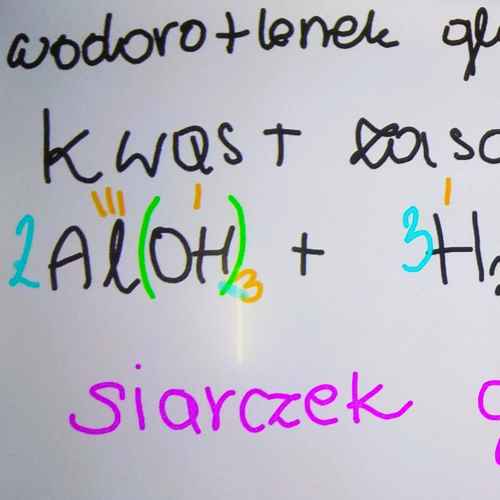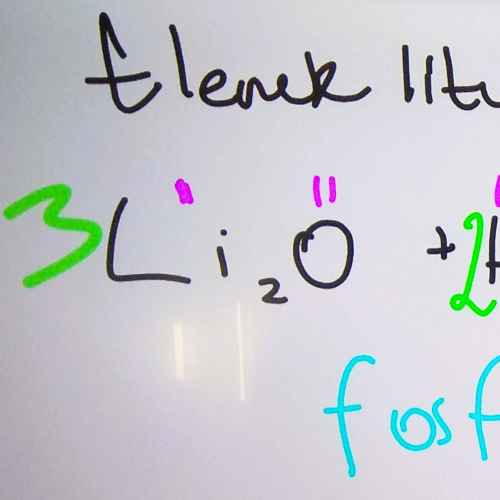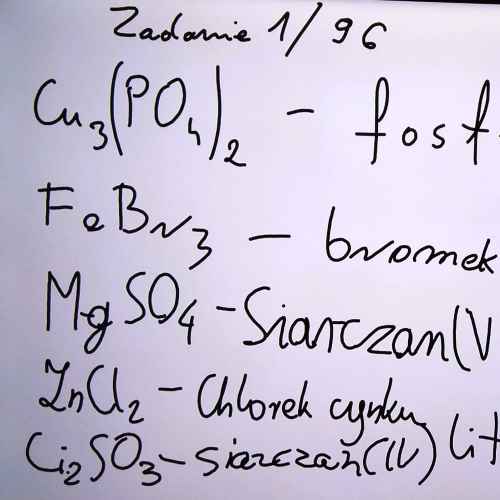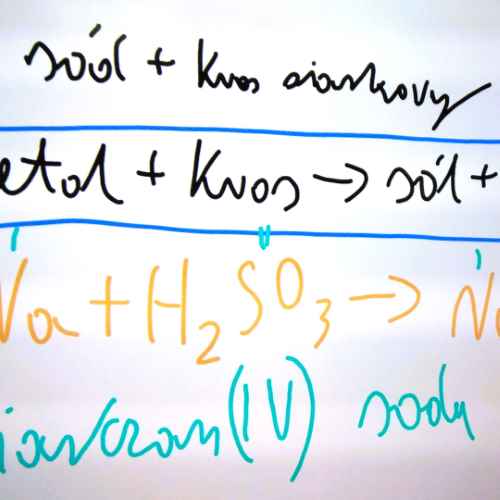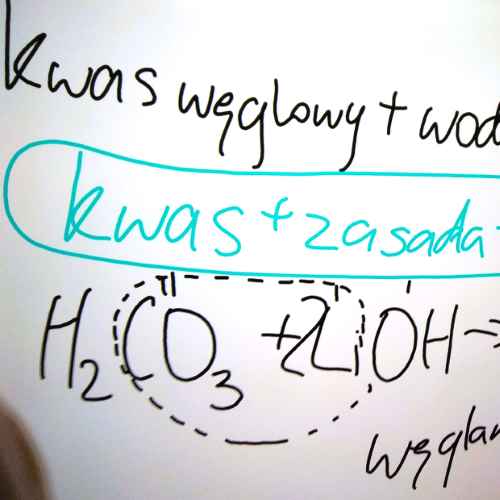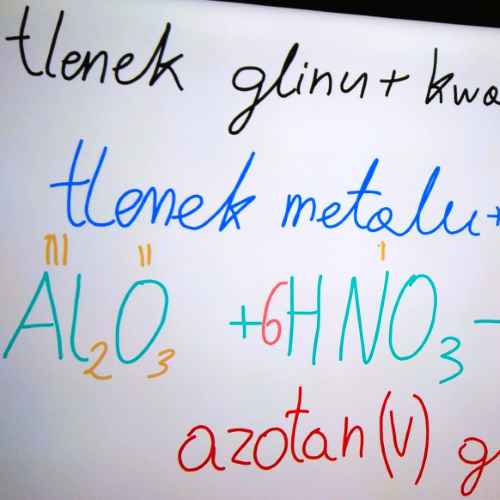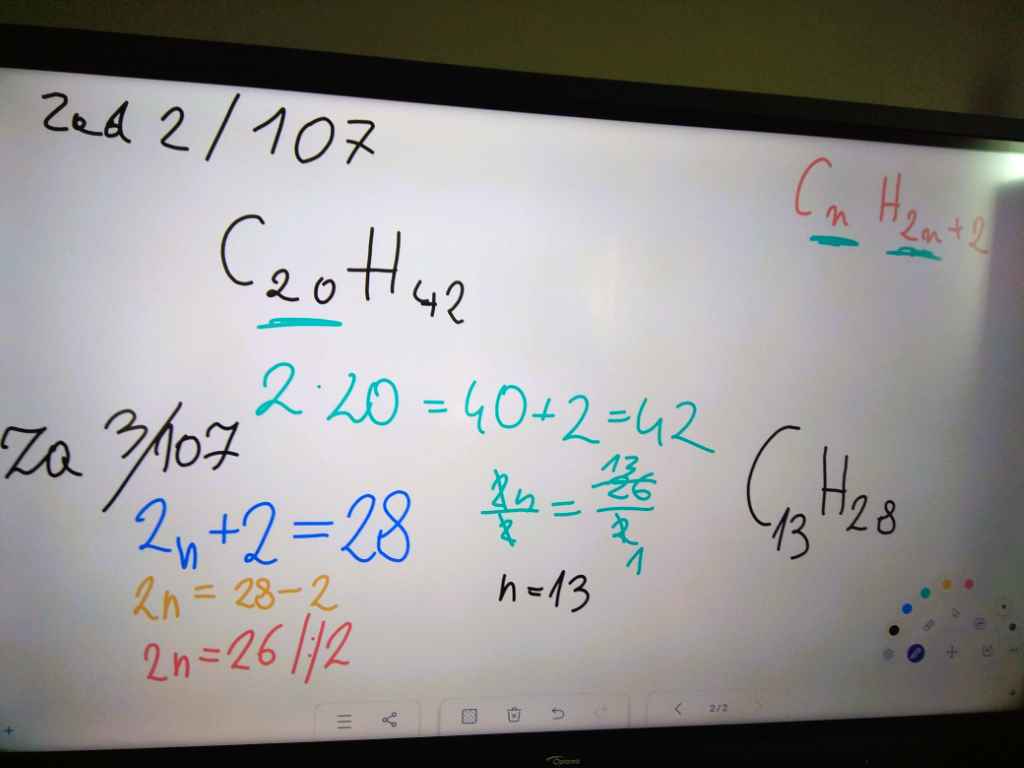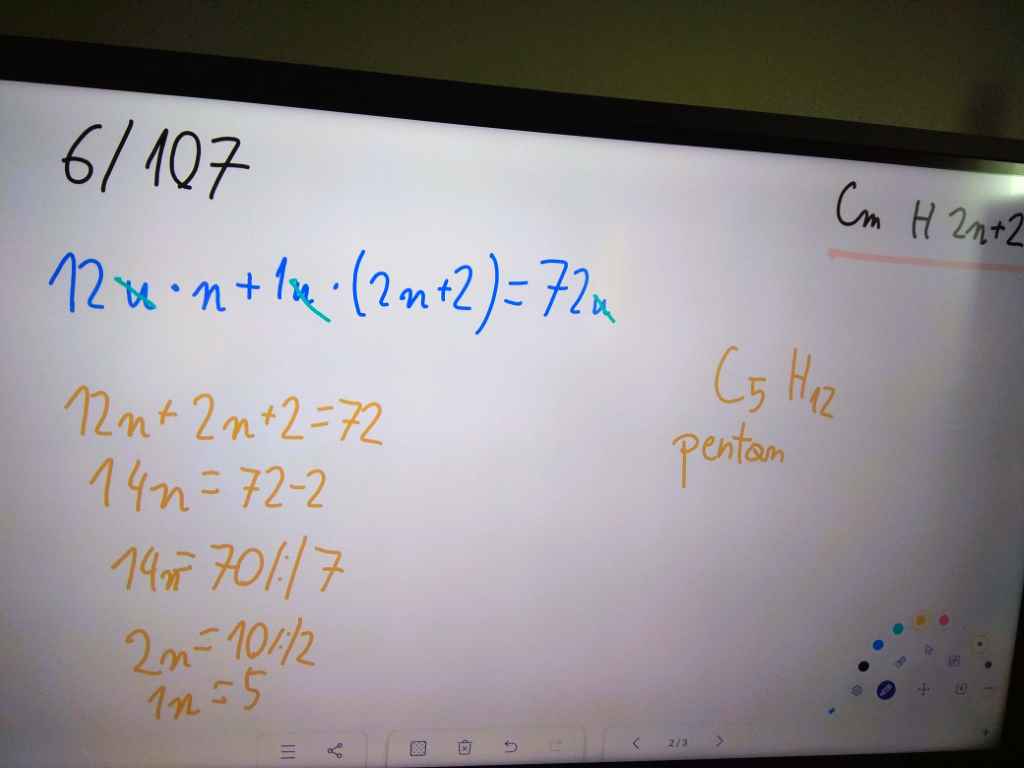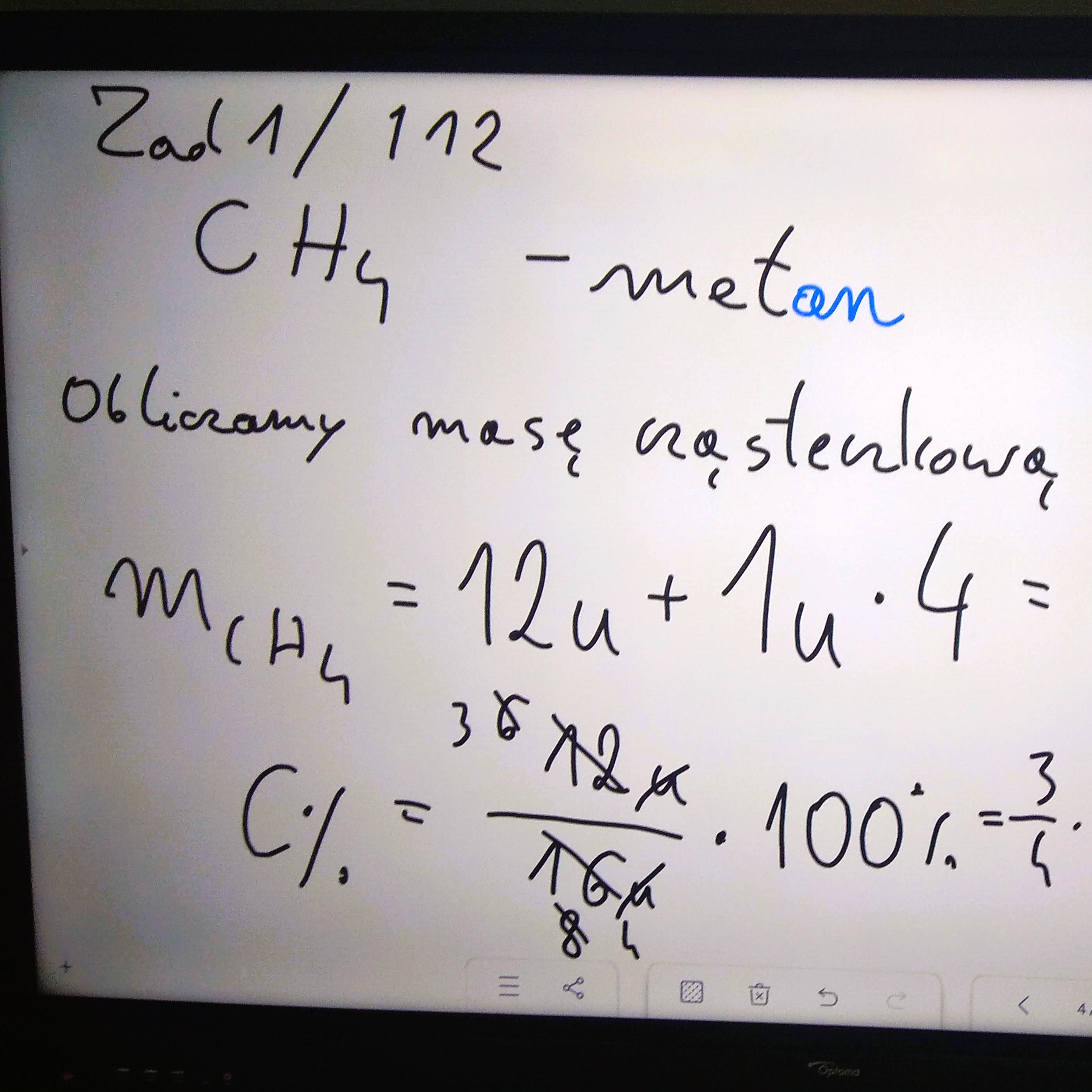Zapoznaliśmy się z podstawowymi kwasami nieorganicznymi. Rozróżniamy kwasy: tlenowe i beztlenowe. Przypominam o końcówkach: dla kwasów beztlenowych (-wodorowy), dla kwasów tlenowych (-owy).
Chemia 8
☘
Kwasy
Kwasy beztlenowe: Kwas chlorowodorowy i siarkowodorowy. Poniżej znajdują się wzory i nazwy wybranych kwasów beztlenowych i tlenowych.
| Nazwa kwasu | Wzór sumaryczny | Rodzaj kwasu |
|---|---|---|
| kwas chlorowodorowy | HCl | kwas beztlenowy |
| kwas siarkowodorowy | H2S | |
| kwas siarkowy (VI) | H2SO4 | kwas tlenowy |
| kwas siarkowy (IV) | H2SO3 | |
| kwas azotowy (V) | HNO3 | |
| kwas węglowy | H2CO3 | |
| kwas fosforowy (V) | H3PO4 |
Proces dysocjacji jonowej kwasów
Z lekcji dowiedzieliśmy się, że cząsteczki elektrolitów (kwasów) pod wpływem cząsteczek wody ulegają rozpadowi na jony dodatnie (kationy) i jony ujemne (aniony).
Dysocjacja jonowa większości kwasów jest reakcją odwracalną, tzn. że cząsteczki rozpadają się na jony, które mogą się łączyć, tworząc ponownie cząsteczki.
Odczyn roztworu - skala pH
Odczyn roztworu - zależy od stężenia zawartości w nim kationów wodoru H+ w stosunku do stężenia anionów wodorotlenkowych OH-. Skala pH obejmuje wartości od 0 do 14. Liczby te informują o stężeniu kationów wodoru H+ w roztworze.
Podsumowanie wiadomości
Na lekcji podsumowaliśmy zdobytą wiedzę na temat kwasów ich rodzajów i podziale. Rozwiązaliśmy wspólnie na tablicy trzy zadania z podręcznika.
Sole
Wzory i nazwy soli
Nazwę soli tworzy się od nazwy kwasu (patrz tabelka poniżej), dodając nazwę metalu i uwzględniając jego wartościowość.
Nazwę soli kwasów beztlenowych mają końcówkę -ek.
Nazwę soli kwasów tlenowych mają końcówkę -an.
| Rodzaje kwasów | Nazwa kwasu | Nazwa soli | Wartościowość reszty kwasowej |
|---|---|---|---|
| kwasy beztlenowe | chlorowodorowy | chlorek | I |
| siarkowodorowy | siarczek | II | |
| kwasy tlenowe | siarkowy (VI) | siarczan (VI) | II |
| siarkowy (IV) | siarczan (IV) | II | |
| azotowy (V) | azotan (V) | I | |
| węglowy | węglan | II | |
| fosforowy (V) | fosforan (V) | III |
Zadanie 1/63
azotan(V) sodu - NaNO3; siarczan(VI) wapnia - CaSO4; chlorek srebra(I) - AgCl; węglan sodu - Na2CO3; siarczek glinu - Al2S3; siarczan(IV) żelaza(III) - Fe2(SO3)3; fosforan(V) wapnia - Ca3(PO4)2
Proces dysocjacji jonowej soli
Woda twarda, której używa się w gospodarstwach domowych zawiera rozpuszczone sole metali, głównie wapnia i magnezu. Podczas jej ogrzewania, np. w czajniku lub w pralce, powstaje kamień kotłowy (zdjęcie obok). Tworzą go trudno rozpuszczalne sole wapnia i magnezu.
| NH4+ | Li+ | Na+ | K+ | Mg2+ | Ca2+ | Sr2+ | |
|---|---|---|---|---|---|---|---|
| Cl - | R | R | R | R | R | R | R |
| S2- | R | R | R | R | R | T | R |
| NO3- | R | R | R | R | R | R | R |
| SO42- | R | R | R | R | R | T | N |
| PO43- | R | R | R | R | N | N | N |
| Br - | R | R | R | R | R | R | R |
Zadanie 1/68
Wskaż, które z soli o podanych wzorach sumarycznych dobrze rozpuszczają się w wodzie. Skorzystaj z tabeli rozpuszczalności soli w wodzie.
Li2S - ________ ; MgS04 - ________ ; (NH4)3PO4 - ________ ; MgBr - ________ ; CaS - ________ ; Sr(NO3)2 - ________ ; CaS04 - ________ ; CaCl2 - ________ ; NaBr - ________ ; LiCl - ________ ; K3PO4 - ________ ;
Reakcje zobojętniania
Reakcja kwasu z zasadą nosi nazwę reakcji zobojętniania. Jest ona jednym ze sposobów otrzymywania soli. W wyniku reakcji kwasu (odczyn kwasowy) z zasadą (odczyn zasadowy) powstaje cząsteczka wody (odczyn obojętny). Reakcja kwasu z zasadą nosi nazwę reakcji zobojętniania lub neutralizacji.
kwas + zasada → sól + woda
W medycynie reakcje zobojętniania wykorzystuje się do zobojętniania nadmiaru wydzielanego soku żołądkowego. Pacjentom cierpiącym na nadkwasotę podaje się leki o odczynie zasadowym. Kwas solny obecny w sokach trawiennych reaguje z wodorotlenkiem wchodzącym w skład leku, a produktem tej reakcji chemicznej są sole. Leki neutralizujące nadmiar soku żołądkowego usuwają jedynie objawy, nie likwidują przyczyny nadkwasoty.
Przykłady reakcji zobojętniania:
HCl + NaOH → NaCl + H2O kwas chlorowodorowy + wodorotlenek sodu → chlorek sodu + woda
H2SO4 + 2 NaOH → Na2SO4 + 2 H2O kwas siarkowy(VI) + wodorotlenek sodu &#; → siarczan(VI) sodu + woda
Reakcje metali z kwasami
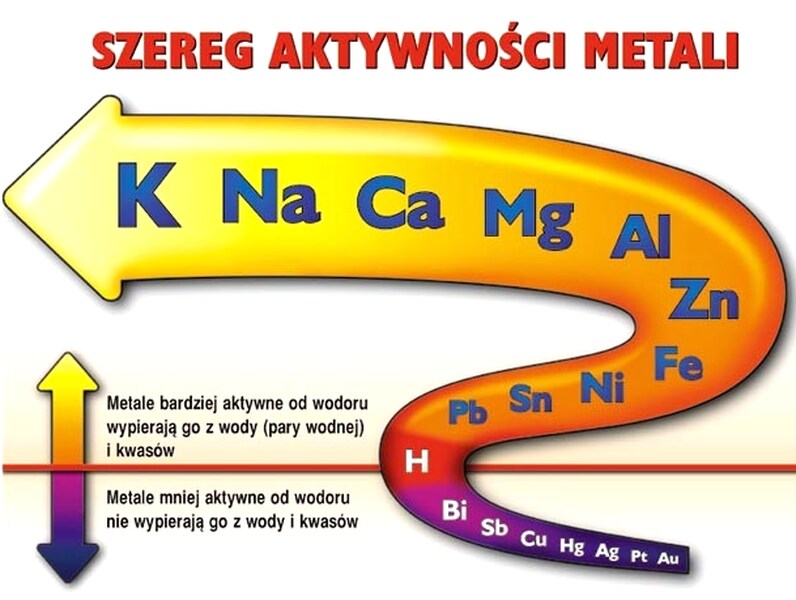
Wszystkie metale można ułożyć w szereg według wzrastającej aktywności chemicznej. Aktywność chemiczną metali określa się na podstawie możliwości wypierania przez nie wodoru z kwasu. Metale umieszczone w szeregu aktywności metali powyżej wodoru są od niego bardziej aktywne.
metal aktywny + kwas → sól + wodór↑
Na podstawie szeregu aktywności metali można określić wzajemną aktywność chemiczną metali, a więc stwierdzić, który z metali jest bardziej aktywny, np. sód czy magnez. Sód jest metalem o większej aktywności chemicznej - w szeregu aktywności znajduje się powyżej magnezu.
Przykłady reakcji:
Mg + 2 HCl → MgCl2 + H2↑ magnez + kwas chlorowodorowy → chlorek magnezu + wodór ↑
Mg + H2SO4 → MgSO4 + H2↑ magnez + kwas siarkowy(VI) → siarczan(VI) magnezu + wodór ↑
Reakcje tlenków metali z kwasami
Tlenek zasadowy - tlenek metalu, który reaguje z kwasem, tworząc sól. Większość tlenków zasadowych reaguje z wodą, tworząc zasady.
tlenek metalu + kwas → sól + woda
Tlenek ołowiu(II) PbO to związek chemiczny o barwie żółtej, który dawniej malarze stosowali jako pigment do farb. Jednak z czasem tlenek ołowiu(II) zamieniał się w siarczek ołowiu(II) PbS - sól o barwie czarnej. Była ona produktem reakcji tlenku ołowiu(II) z siarkowodorem H2S, występującym w niewielkich ilościach w powietrzu. Obecnie nie używa się tego pigmentu w malarstwie ze względu na toksyczne właściwości związków ołowiu(II).
Przykłady reakcji:
MgO + 2 HCl → MgCl2 + H2O tlenek magnezu + kwas chlorowodorowy → chlorek magnezu + woda
CuO + 2 HCl → CuCl2 + H2O tlenek miedzi(II) + kwas chlorowodorowy → chlorek miedzi(II) + woda
Reakcje wodorotlenków metali z tlenkami niemetali
Fresk to technika malarstwa ściennego, która polega na malowaniu na mokrym tynku. Barwnik jest rozprowadzany wodą, a jednym ze składników tynku jest wapno gaszone, czyli wodorotlenek wapnia Ca(OH)2. Wapno gaszone z tlenkiem węgla(IV) CO2 tworzy węglan wapnia CaCO3, który trwale wiąże farbę.
wodorotlenek + tlenek niemetalu → sól + woda
Reakcja wodorotlenku metalu z tlenkiem niemetalu zachodzi wówczas, gdy wodorotlenek jest zasadą, a tlenek niemetalu jest tlenkiem kwasowym. Tlenek kwasowy - tlenek, najczęściej niemetalu, który reaguje z zasadą, tworząc sól. Niektóre tlenki kwasowe, np. CO2, SO2, SO3, N2O5 reagują też z wodą, tworząc kwasy.
Przykład reakcji:
Ca(OH)2 + CO2 → CaCO3↓ + H2O wodorotlenek wapnia + tlenek węgla(IV) → węglan wapnia↓ + woda
Reakcje strąceniowe
Reakcje strąceniowe są to reakcje chemiczne, w których wyniku powstają produkty trudno rozpuszczalne lub praktycznie nierozpuszczalne w wodzie.
sól 1 + kwas 1 → sól 2↓ + kwas 2
Przykłady reakcji:
AgNO3 + HCl → AgCl↓ + HNO3 azotan(V) srebra(I) + kwas chlorowodorowy → chlorek srebra(I) + kwas azotowy(V)
Korzystając z tabeli rozpuszczalności i wodorotlenków w wodzie, możemy ustalić, że powstałym osadem jest praktycznie nierozpuszczalny chlorek srebra(I) AgCl. Zapis strzałki w dół oznacza, że mamy do czynienia z wytrąconym osade - praktycznie nierozpuszczalny.
sól 1 + zasada 1 → sól 2↓ + zasada 2
Przykłady reakcji:
Na2SO4 + Ca(OH)2 → CaSO4↓ + 2 NaOH siarczan(VI) sodu + wodorotlenek wapnia → siarczan(VI) wapnia + wodorotlenek sodu
sól 1 + sól 2 → sól 3↓ + sól 4
Przykłady reakcji:
2 Na3PO4 + 3 Ca(NO3)2 → Ca3(PO4)2↓ + 6 NaNO3 fosforan(V) sodu + azotan(V) wapnia → fosforan(V) wapnia + azotan(V) sodu
Metody otrzymywania soli - utrwalenie wiadomości
Przykłady równań:
- (1) kwas siarkowy(VI) + wodorotlenek litu
- (2) sód + kwas węglowy
- (3) tlenek glinu + kwas azotowy(V)
- (4) wodorotlenek srebra + węglan sodu
- (5) fosforan(V) litu + kwas fluorowodorowy
- (6) azotan(V) wapnia + wodorotlenek strontu
Związki węgla z wodorem
Naturalne źródła węglowodorów
Związki chemiczne dzielimy na:
- organiczne – powstające z obumarłych zwierząt lub roślin;
- nieorganiczne – powstające z minerałów.
Naturalne źródła węglowodorów
- gaz ziemny;
- ropa naftowa;
- węgle kopalne.
Węglowodory to związki organiczne, w których skład wchodzą: węgiel i wodór.
Ropa naftowa jest mieszaniną węglowodorów o różnych temperaturach wrzenia. Do rozdzielenia ropy naftowej na składniki wykorzystuje się proces destylacji. Produktami destylacji są mieszaniny składników o podobnych temperaturach wrzenia.
Podczas destylacji ropy naftowej powstają: gazy rafinaryjne (głównie propan i butan), benzyny, nafty, oleje napędowe i mazuty.
Szereg homologiczny alkanów
Związki organiczne uporządkowane w szeregu homologicznym mają podobne właściwości, ale w ich cząsteczkach zwiększa się liczba atomów węgla.
Oznacza to, że kolejne związki chemiczne tworzące ten szereg homologiczny mają coraz większe cząsteczki
Alkany należa do węglowodorów nasyconych. Węglowodory nasycone to takie, w których cząsteczkach występują wyłącznie wiązania pojedyńcze między atomami węgla.
Co to są alkany?
Alkany należą do węglowodorów nasyconych. Węglowodory nasycone to takie, w których cząsteczkach występują wyłącznie wiązania pojedyńcze między atomami węgla.
Nazwy pierwszych czterech alkanów - metan, etan, propan i butan - są nazwami zwyczajowymi. Nazwy kolejnych węglowodorów nasyconych tworzy się od liczebników greckich określających liczbę atomów węgla w cząsteczce z daną końcówką -an, np. pentan.
| Liczba atomów węgla w cząsteczce | Nazwa | Wzór sumaryczny | Wzór strukturalny | Wzór półstrukturalny | Wzór grupowy |
|---|---|---|---|---|---|
| 1 | metan | CH4 |
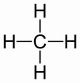
|
CH4 | CH4 |
| 2 | etan | C2H6 |
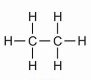
|
CH3 - CH3 | CH3CH3 |
| 3 | propan | C3H8 |
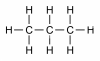
|
CH3 - CH2 - CH3 | CH3CH2CH3 |
| 4 | butan | C4H10 |
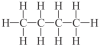
|
CH3 - CH2 - CH2 - CH3 | CH3(CH2)2CH3 |
| 5 | pentan | C5H12 |
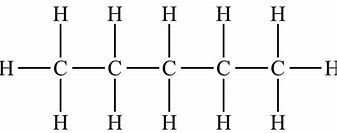
|
CH3 - CH2 - CH2 - CH2 - CH3 | CH3(CH2)3CH3 |
| 6 | heksan | C6H14 |
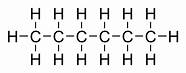
|
CH3 - CH2 - CH2 - CH2 - CH2 - CH3 | CH3(CH2)4CH3 |
| 7 | heptan | C7H16 |
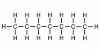
|
CH3 - CH2 - CH2 - CH2 - CH2 - CH2 - CH3 | CH3(CH2)5CH3 |
| 8 | oktan | C8H18 |
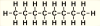
|
CH3 - CH2 - CH2 - CH2 - CH2 - CH2 - CH2 - CH3 | CH3(CH2)6CH3 |
| 9 | nonan | C9H20 |
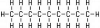
|
CH3 - CH2 - CH2 - CH2 - CH2 - CH2 - CH2 - CH2 - CH3 | CH3(CH2)7CH3 |
| 10 | dekan | C10H22 |
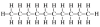
|
CH3 - CH2 - CH2 - CH2 - CH2 - CH2 - CH2 - CH2 - CH2 - CH3 | CH3(CH2)8CH3 |
Metan i etan
Metan to główny składnik gazu ziemnego. Wykorzystuje się go w urządzeniach gazowych, jest pierwszym związkiem chemicznym w szeregu homologicznym alkanów.
Metan z powietrzem tworzą mieszaninę wybuchową. Pod wpływem czynników zewnętrznych, np. iskry elektrycznej, ogrzania, wstrząsu, mieszanina może eksplodować.
Metan CH4 jest zaliczany do gazów cieplarnianych. Gaz ten dostaje się do atmosfery m.in. z bagien i pól ryżowych oraz w wyniku eksploatacji złóż paliw kopalnych.
| Właściwości CH4 | |||
|---|---|---|---|
| Właściwości fizyczne: | Właściwości chemiczne: | ||
| • gaz | • bezwonny | ||
| • bezbarwny | • mało reaktywny | ||
| • ma gęstość mniejszą od gęstości powietrza | • ulega reakcjom spalania | ||
| • nierozpuszczalny w wodzie | |||
Etan C2H6 jest drugim związkiem chemicznym w szeregu homologicznym alkanów.
| Właściwości C2H6 | |||
|---|---|---|---|
| Właściwości fizyczne: | Właściwości chemiczne: | ||
| • gaz | • bezwonny | ||
| • bezbarwny | • mało reaktywny | ||
| • ma gęstość większą od gęstości powietrza | • ulega reakcjom spalania | ||
| • nierozpuszczalny w wodzie | |||
W reakcji spalania węglowodorów powstają różnego rodzaju produkty. W zależności od ilości dostarczonego tlenu reakcje spalania dzielimy na:
- spalanie całkowite - gdzie produktami są: woda i tlenek węgla(IV);
- spalanie niecałkowite - w wyniku których powstaje woda i tlenek węgla(II); lub węgiel.
Porównanie właściwości alkanów i ich zastosowań
Wszystkie węglowodory nasycone, niezależnie od stanu skupienia, mają gęstość mniejszą od gęstości wody i nie rozpuszczają się w niej. Są palne.
Wraz ze zwiększaniem się liczby atomów węgla w cząsteczce zmienia się stan skupienia alkanów, zmniejszają się ich lotność i palność. Natomiast zwiększają się ich temperatury wrzenia topnienia oraz gęstość.
| Stan skupienia w temp. 20 °C | gazy | ciecze | substancje stałe |
|---|---|---|---|
| Liczba atomów węgla w cząsteczce n | 1 ≤ n ≤ 4 | 5 ≤ n ≤ 16 | n ≥ 17 |
| Przykłady | CH4 | C5H12 | C17H36 |
| metan | pentan | heptadekan | |

|

|

|
|
| gaz w zapalniczkach - butan | benzyna i nafta - mieszanina węglowodorów | smary i asfalt - mieszanina węglowodorów |
Jakie właściwości ma benzyna?
Benzyna jest mieszaniną ciekłych węglowodorów - przede wszystkim alkanów, zawierających w cząsteczce od 5 do 12 atomów węgla. Jest wykorzystywana przede wszystkim jako paliwo samochodowe i lotnicze. Otrzymuje się ją w wyniku destylacji ropy naftowej.
Jak przebiega reakcja spalania butanu?
Spalanie niecałkowite: 2 C4H10 + 5 O2 → 8 C + 10 H2O
Tak zwane półspalanie: 2 C4H10 + 9 O2 → 8 CO + 10 H2O
Spalanie całkowite: 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
Wniosek: Z powyższych równań można zauważyć, że im więcej bierze udział cząsteczek tlenu w reakcji tym mamy do czynienia z lepszym spalaniem tzn. całkowitym w którym produktami są woda i tlenek węgla(IV).
Zadanie 1/118
Napisz równania reakcji:
- spalania całkowitego propanu;
- spalania niecałkowitego pentanu;
- półspalania etanu;
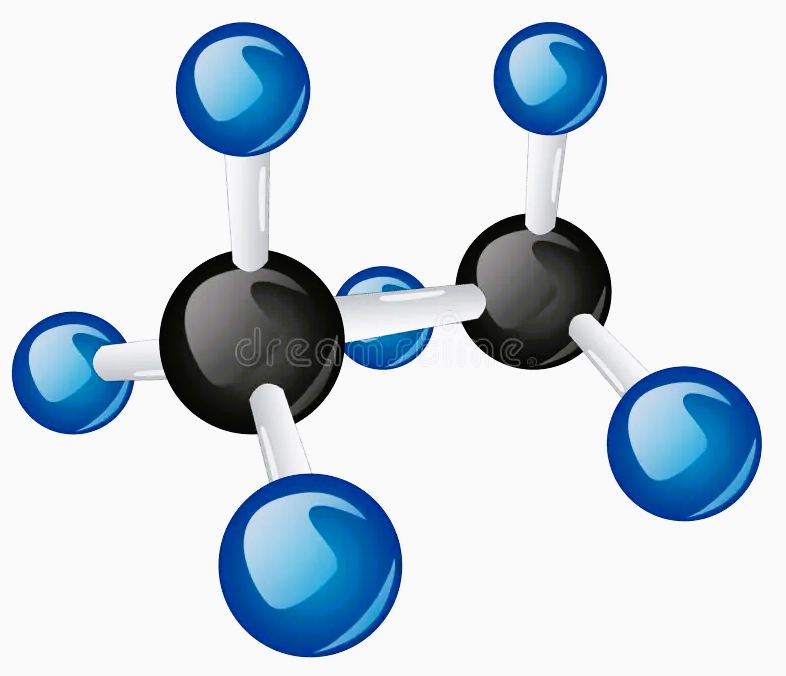
Szereg homologiczny alkenów. Eten
W cząsteczkach węglowodorów nasyconych między atomami węgla występują wyłąznie wiązanie pojedyńcze. Jednak atomy węgla mogą łączyć się ze sobą także wiązaniami podwójnymi lub wiązaniami potrójnymi, nazywanymi wiązaniami wielokrotnymi. Węglowodory, których cząsteczki zawierają wiązania wielokrotne, to węglowodory nienasycone.
Eten jest to pierwszy związek chemiczny w szeregu homologicznym węglowodorów nienasyconych tzw. alkenów. Związek ten przyspiesza dojrzewanie owoców, można się o tym przekonać poprzez umieszczenie niedojrzałych bananów w jednej torebce z dojrzałym jabłkiem. Wydzielony przez jabłko eten przyspieszy dojrzewanie banana.
Co to są alkeny?
Alkeny to węglowodory nienasycone, których cząsteczki zawierają jedno wiązanie podwójne między atomami węgla. Pozostałe atomy węgla łączą się wiązaniami pojedyńczymi. Podobnie jak alkany, alkeny tworzą szereg homologiczny.
Nazwę alkenu tworzy się od nazwy alkanu o tej samej liczbie atomów węgla w cząsteczce, zmieniając końcówkę z -an na -en. Na podstawie analizy wzorów alkenów w szeregu homologicznym można podać wzór ogólny:
CnH2n
n - liczba naturalna; liczba atomów węgla w cząsteczce alkenu; n > 1.
| Liczba atomów węgla w cząsteczce | Nazwa | Wzór sumaryczny | Wzór strukturalny | Wzór półstrukturalny | Wzór grupowy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | --- | --- |
|
--- | --- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | eten | C2H4 |
|
CH2 = CH2 | CH2CH2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | propen | C3H6 |
|
CH2 = CH - CH3 | CH2CHCH3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | buten | C4H8 |
|
CH2 = CH - CH2 - CH3 | CH2CHCH2CH3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | penten | C5H10 |
|
CH2 = CH - CH2 - CH2 - CH3 | CH2CH(CH2)2CH3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | heksen | C6H12 |
|
CH2 = CH - CH2 - CH2 - CH2 - CH3 | CH2CH(CH2)3CH3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | hepten | C7H14 |
|
CH2 = CH - CH2 - CH2 - CH2 - CH2 - CH3 | CH2CH(CH2)4CH3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 | okten | C8H16 |
|
CH2 = CH - CH2 - CH2 - CH2- CH2 - CH2 - CH3 | CH2CH(CH2)5CH3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | nonen | C9H18 |
|
CH2 = CH - CH2 - CH2 - CH2 - CH2- CH2 - CH2 - CH3 | CH2CH(CH2)6CH3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10 | deken | C10H20 |
|
CH2 = CH - CH2 - CH2 - CH2 - CH2 - CH2- CH2 - CH2 - CH3 | CH2CH(CH2)7CH3 |
Jakim reakcjom chemicznym ulega eten?
Eten, podobnie jak alkany, ulega reakcjom spalania. W zależności od ilości dostarczonego tlenu zachodzi:
• Spalanie niecałkowite: C2H4 + O2 → 2 C + 2 H2O
• Tak zwane półspalanie: C2H4 + 2 O2 → 2 CO + 2 H2O
• Spalanie całkowite: C2H4 + 3 O2 → 2 CO2 + 2 H2O
Wniosek: Z powyższych równań można zauważyć, że im więcej bierze udział cząsteczek tlenu w reakcji tym mamy do czynienia z lepszym spalaniem tzn. całkowitym w którym produktami są woda i tlenek węgla(IV).
Na czym polega reakcja przyłączenia?
W wiązaniu podwójnym jedno z wiązań jest słabsze i podczas reakcji chemicznej ulega rozerwaniu (po prostu „pęka”). Zachodzi wówczas reakcja przyłączania, którą przedstawia poniższe równanie:
| H | H | H | H | |||||||||||||||
| | | | | | | | | |||||||||||||||
| C | = | C | + | Br | ― | Br | → | H | ― | C | ― | C | ― | H | ||||
| | | | | | | | | |||||||||||||||
| H | H | Br | Br | |||||||||||||||
| eten | brom | dibromoetan | ||||||||||||||||
C2H4 + Br2 → C2H4Br2
eten brom dibromoetan
Podsumowanie wiadomości - alkany, alkeny i alkiny
1. Napisz wzór sumaryczny i strukturalny:
• butenu
• heptynu
2. Napisz równanie reakcji spalania:
• całkowitego propanu.
• półspalania heksynu.